自2021年6月以来,伴随着专利法第四次修订正式施行,中国版的药品专利链接制度正式拉开序幕,随着该制度的建立,国内药品保护现状也将掀起波澜,药品市场的竞争格局也将有所波动。接下来,笔者将针对药品专利链接制度从多方位作出梳理,并探讨专利链接制度下可能的纠纷样态,以期对我国专利链接制度做出深入了解。
part 01药品专利链接制度概述

图1 药品专利链接制度释义
药品专利链接制度,顾名思义,其主要起“链接”作用,是仿制药上市批准体系与创新药品专利体系相“链接”,即仿制药注册申请应当考虑先前已上市药品的专利状况,从而避免可能的专利纠纷。与以往的专利纠纷相比,其可以理解为更为特殊的专利纠纷,其特殊性体现在时间上,药品专利链接制度的存在将以往的专利纠纷解决前置化了,可将纠纷放置到仿制药上市审批阶段,为何需要如此呢,这就需要结合药品专利链接制度制定的目的一探究竟了。

图2 药品专利链接制度制定目的
我国之所以推出并建立药品专利链接制度,将药品专利纠纷的解决提前到仿制药上市审批过程,主要是希望更为有效地帮助仿制药企和原研药企定分止争,从根本上为了平衡多边利益,一方面促进原研药企业的市场发展,通过该制度为原研药企提前锁定风险点,将其扼杀在摇篮里,以便稳定自身的市场份额,并且提升原研药企业进行新药研究的热情,另一方面促进仿制药企,提前了解专利壁垒,做好规划再进入市场,以免后期陷入纠纷,以致前期投入付之东流。因此,药品专利链接制度促进了原研药企、仿制药企、国家药品监督管理局、国家知识产权局及法院在相关药品上市审批程序与相关药品专利纠纷解决程序的互动与衔接,保护药品创新的同时鼓励和促进仿制药尽早上市,进而促进整个医药行业良性有序发展,从而最终也为社会公众带来了药品可及性以及稳定性。
part 02药品专利链接制度发展历程
谈起药品专利链接制度的发展,不得不提到美国,它是最早提出药品专利链接制度的国家,通过分析美国的药品专利链接制度的发展及特点,了解药品专利链接制度如何应运而生。
1962年,美国Kefauver-Harris Act生效后,FDA要求所有药品(包括仿制药)上市前都应进行安全性与有效性的临床验证试验,并在相应的药品专利过期后才能递交仿制药申请,该法案的负面作用是加大了新药研发成本,并延迟了仿制药的上市时间,使药品价格节节攀升,新药开发商与社会公众的利益矛盾不断升级,为此,美国药品专利链接制度拉开帷幕。
1984年美国国会通过《Hatch-Waxman法案》建立了药品专利链接制度,该法案又称《药品价格竞争与专利期补偿法》,是美国历史上著名的法案,该法案提出了药品专利链接制度的同时,还提出了“Bolar例外”原则、药品试验数据保护制度、专利补偿期制度、仿制药简化申请制度等。该法案被誉为当今美国仿制药的催化剂,对美国乃至世界制药产业产生了深远的影响。
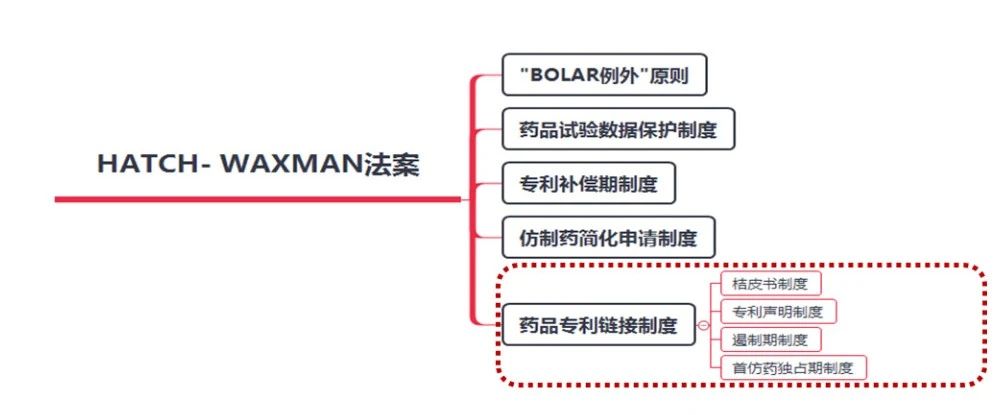
图3 Hatch-Waxman法案内容
美国的药品专利链接制度,主要可分为4个版块,分别为桔皮书制度、专利声明制度、遏制期制度以及首仿药独占期制度。
(1)桔皮书制度:美国食品药品监督管理局(FDA)将所有与简略新药申请(ANDA)同时提交的有效专利的信息录入到《经治疗等同性评价标准的药品》,又称为桔皮书,录入桔皮书的专利称为登记专利,桔皮书的信息提供了专利链接制度的基础,即意味着只有录入桔皮书的专利才有可能启动专利链接制度。
(2)专利声明制度[1]:仿制药提出申请时,就要针对桔皮书里面列出的每一个专利,做出专利声明。美国的专利声明可以划分为两大类,第一大类就是我们通常所谓的Certification,另外一大类包括两个Statement。Certification声明包括四类:I桔皮书中没有相关专利;Ⅱ 桔皮书所列专利保护期已届满;Ⅲ 在桔皮书所列专利保护期届满前仿制药不会上市;Ⅳ(也称“专利挑战”)桔皮书所列的专利无效、不可实施或者生产商是仿制药不会侵犯专利权。Statement声明包括两类:I针对的是药品使用方法专利。如果一个原研药有多个适应症,只有部分适应症是受专利保护的情况下,仿制药企业可以在其仿制药上市申请中将受到专利保护的适应症删除,即不寻求获得批准受专利保护的适应症,那这个仿制药就不会侵犯该使用方法专利,这个时候可以作出这样的声明。Ⅱ没有专利的声明,可以声明说没有专利。其中需要补充说明一点,Statement的第Ⅱ类声明,没有专利,不再限于桔皮书范围内所列出的专利,而是仿制药申请人认为不存在相关专利。
(3)遏制期制度:对于列入桔皮书中的专利,如果仿制药申请人提出了第Ⅳ类专利声明,则只要专利权人在法定期限内提起专利侵权诉讼,即可以自动获得最长达30个月的仿制药审批遏制期。
(4)首仿药独占期制度:仿制药企业提交第IV段申明获胜后,拥有180天的市场独占期。该180天的市场独占期从仿制药上市的第一天起算。在此180天市场独占期期间,FDA不再批准相同的ANDA上市。
以上是美国药品专利链接制度,需要说明一点,美国药品专利链接制度仅针对化学药,不涉及生物药。其中专利挑战和遏制期制度构成了美国药品专利链接制度的核心基础。通过专利挑战,仿制药企业可以寻求在专利到期前上市仿制药,但是,30个月的遏制期也会被专利权人用于推迟仿制药竞争,从而延长其市场独占期。
针对药品专利链接制度,时至今日,美国已践行40年左右,过程中也遇到了各种各样的问题和困难,因此在实践过程中也出台了其他的法律法规来平衡药品专利链接制度落地的缺陷,以致药品专利链接制度的有序推行,从而为美国的药品发展起到了积极的推动作用。
在药品行业,专利在其市场的竞争格局中扮演了举足轻重的角色,因为专利的存在,将药品生产者划分为原研药企和仿制药企,因为行业内多重竞争关系的同台竞演,也让药品的发展存在不稳定的因素,从而波及到社会公众,导致没有新药购买或者购买高价药品,因此,重视药品专利也成为各个国家统一态度,在我国亦是如此,医药产业是我国国民经济发展的重要组成部分,也是重要的民生基础之一,为了加强药品的稳定发展,推行药品专利链接制度的落地也是大势所趋。
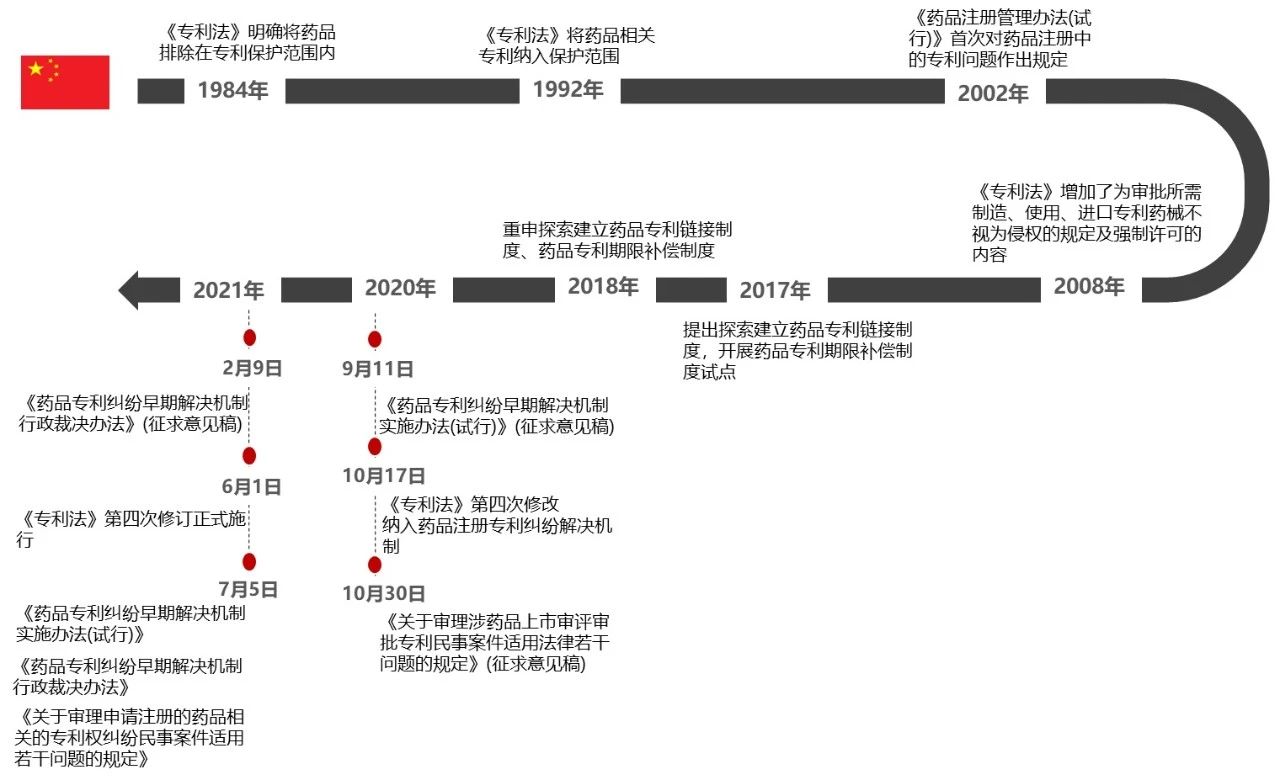
图4 中国药品专利链接制度发展
我国专利保护始于1984年,早期的《专利法》明确指出药品专利不在专利法保护范围内。1992年9月4日,第七届全国人大常委会第27次会议通过了修改《专利法》的决定,修改后的《专利法》取消了“对食品、饮料和调味品,药品和用化学方法获得的物质不授予专利权”的限制,药品相关知识产权正式纳入《专利法》管理。到2002年,《药品注册管理办法(试行)》首次对药品注册中的专利问题作出规定。
2008年,《专利法》增加了为审批所需制造、使用、进口专利药械不视为侵权的规定及强制许可的内容,从以上来看,我国对药品相关知识产权的发展重视度在逐渐加强。随着药品行业的快速发展,原研药企和仿制药企的激烈竞争,仿制药企业在药品注册过程中没有明确的法律环境。为了药品行业的稳定发展, 2017年中国开始提出探索建立药品专利链接制度,开展药品专利期限补偿制度试点。2018年,重申探索建立药品专利链接制度、药品专利期限补偿制度,为药品专利链接制度的落地起到了积极的推动作用。2020年,开始为药品专利链接制度的正式施行做准备工作,《专利法》第四次修改中纳入了药品注册专利纠纷解决机制,发布了《药品专利纠纷早期解决机制实施办法(试行)》(征求意见稿),以及《关于审理涉药品上市审评审批专利民事案件适用法律若干问题的规定》(征求意见稿)。2021年6月,伴随着专利法第四次修订正式施行,中国版的药品专利链接制度正式融入到药品发展中,为药品的发展保驾护航。
part 03中国药品专利链接制度
相关法律法规
我国目前的药品专利链接制度是由4个法律法规文件构成:《专利法》第76条、国家药品监督管理局和国家知识产权局联合发布《药品专利纠纷早期解决机制实施办法(试行)》(简称《实施办法》)、国家知识产权局制定的《药品专利纠纷早期解决机制行政裁决办法》以及最高人民法院《关于审理申请注册的药品相关的专利权纠纷民事案件适用法律若干问题的规定》(简称《司法解释》)。
2021年6月1日正式施行的《专利法》第76条引入了药品专利链接制度,即正式将药品专利链接制度纳入法律保护,具体内容如下:药品上市审评审批过程中,药品上市许可申请人与有关专利权人或者利害关系人,因申请注册的药品相关的专利权产生纠纷,相关当事人可以向人民法院起诉,请求就申请注册的药品相关技术方案是否落入他人药品专利权保护范围作出判决。国务院药品监督管理部门在规定的期限内,可以根据人民法院生效裁判作出是否暂停批准相关药品上市的决定。
药品上市许可申请人与有关专利权人或者利害关系人也可以就申请注册的药品相关的专利权纠纷,向国务院专利行政部门请求行政裁决。
国务院药品监督管理部门会同国务院专利行政部门制定药品上市许可审批与药品上市许可申请阶段专利权纠纷解决的具体衔接办法,报国务院同意后实施。
除了专利法对药品专利链接制度的引入,紧接着2021年7月5日发布了《药品专利纠纷早期解决机制实施办法》(试行),其主要内容包括:平台建设和信息公开制度、专利权登记制度、仿制药专利声明制度、司法链接和行政链接制度、批准等待期制度、药品审评审批分类处理制度、首仿药市场独占期制度等。《实施办法》进一步完善了药品专利链接制度,旨在为当事人在相关药品上市审评审批环节提供相关专利纠纷解决的机制,保护药品专利权人合法权益,降低仿制药上市后专利侵权风险。
2021年7月5日发布了《药品专利纠纷早期解决机制行政裁决办法》,其主要内容包括:对行政裁决的请求主体、可裁决的药品专利范围、与司法途径的协调、行政裁决与无效程序的关系、行政裁决的执行与公开、行政裁决的司法救济以及其他办案程序等内容进行了规定。
同日最高人民法院发布了《最高人民法院关于审理申请注册的药品相关的专利权纠纷民事案件使用法律若干问题的规定》,该司法解释对管辖法院、具体案由、起诉材料、诉权行使方式、行政与司法程序衔接、抗辩事由、诉讼中商业秘密保护、行为保全、败诉反赔、送达方式等作了规定,为及时公正审理好该类案件提供了明确指引,推动药品专利链接制度落地见效。
part 04中国药品专利链接制度适用范围
与美国专利链接制度中的“桔皮书”相仿,我国建立了上市药品专利信息登记和公开制度,登记平台为中国上市药品专利信息登记平台,网址 为https://zldj.cde.org.cn/home,该平台于2021年7月4日正式运行。该平台的搭建意味着只有在该平台上登记和公开的专利适用于药品专利链接制度。

图5 中国上市药品专利信息登记平台界面
同时对登记药品专利类型作出了限定,可以登记的专利共8种类型,包括化学药3种:药物活性成分化合物专利、含活性成分的药物组合物专利、医药用途专利;中药3种:中药组合物专利、中药提取物专利、医药用途专利;生物制品2种:活性成分的序列结构专利、医药用途专利。官方关于《实施办法》的政策解读特别强调了不可登记的专利包括中间体、代谢产物、晶型、制备方法、检测方法等专利。
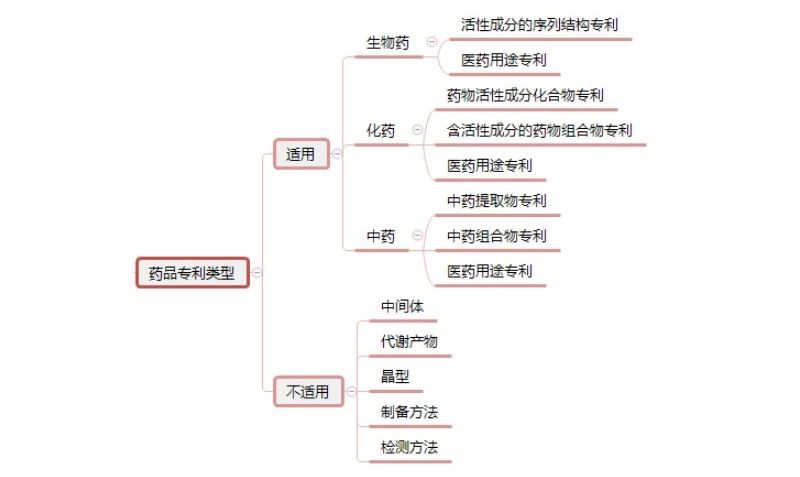
图6 中国药品专利链接制度适用范围
与美国专利药品链接制度不同的是,中国药品专利链接制度根据中国的本土情况,增加了中药适用类型,其次也包括了生物药。
part 05中国药品专利链接制度适用流程
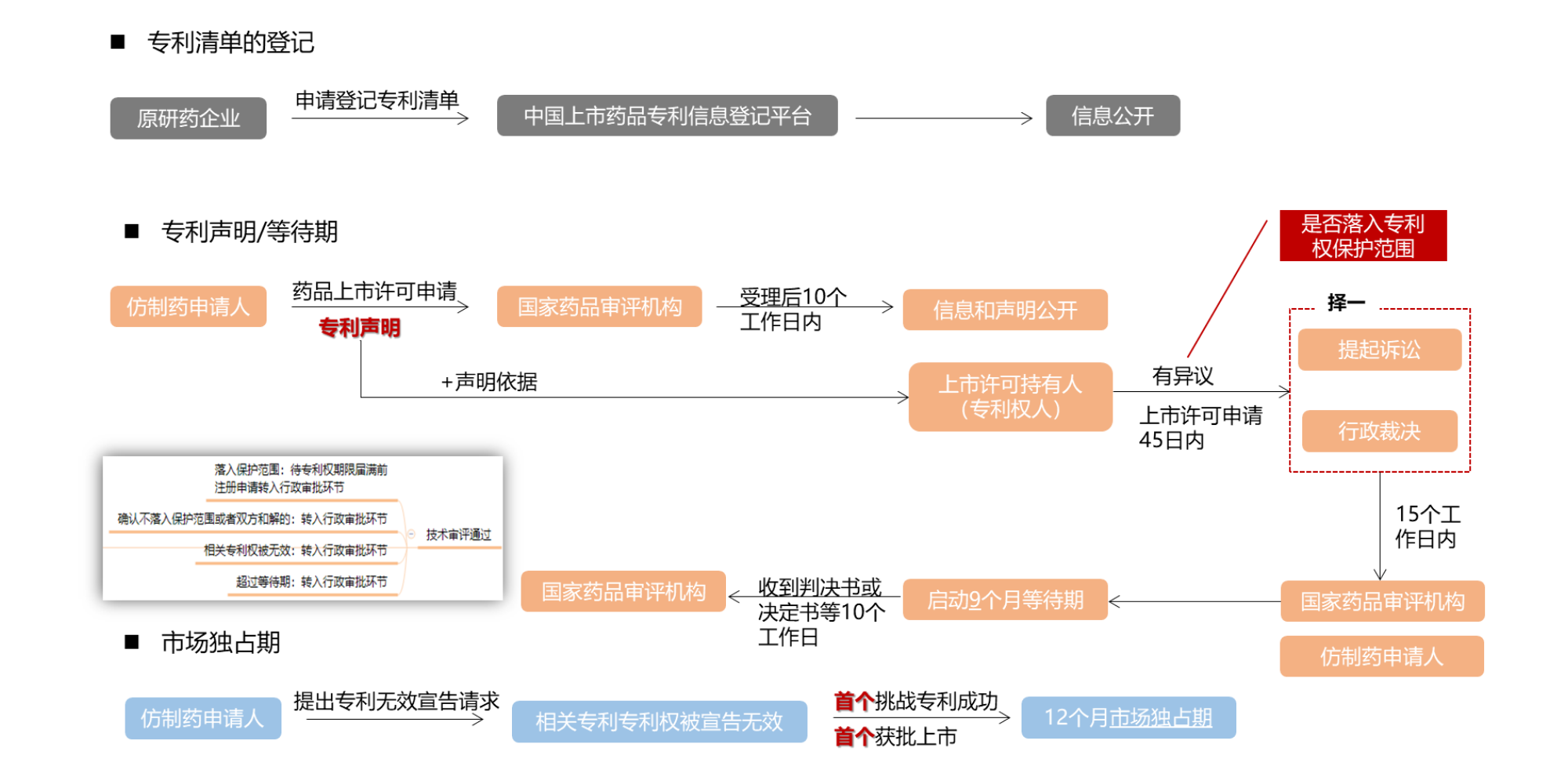 图7 中国药品专利链接制度适用流程
图7 中国药品专利链接制度适用流程
关于上述流程中,体现几个主要点需要详细说明:
(1)关于专利声明,包括四类:
一类声明:中国上市药品专利信息登记平台中没有被仿制药的相关专利信息;
二类声明:中国上市药品专利信息登记平台收录的被仿制药相关专利权已终止或被宣告无效,或者仿制药申请人已获得专利权人相关专利实施许可;
三类声明:中国上市药品专利信息登记平台收录的有被仿制药相关专利,仿制药申请人承诺在相应专利权有效期届满之前所申请的仿制药暂不上市;
四类声明:中国上市药品专利信息登记平台收录的有被仿制药相关专利应当被宣告无效,或者其仿制药未落入相关专利权保护范围。
其中关于一、二类声明,依据技术审评结论作出是否批准上市的决定。三类声明,通过技术审评的,作出批准上市决定,相关药品在专利权有效期和市场独占期届满后上市。四类声明,药品专利权人或者利害关系人对四类声明有异议的,在45日内提起诉讼或者请求行政裁决。
(2)关于9个月等待期,需要注意:
①等待期自人民法院立案或者国务院专利行政部门受理之日起,只设置一次。
②等待期内国家药品评审机构不停止技术审评。
③等待期触发条件:在专利权人或利害关系人在法定期限内就申请上市药品的相关技术方案是否落入相关专利权保护范围提起诉讼或者请求行政裁决的情况下,才会触发9个月的等待期,但仅针对化学药。
(3)12个月独占期,需要注意:
①国务院药品监督管理部门在该药品获批之日起12个月内不再批准同品种仿制药上市,共同挑战专利成功的除外。
②市场独占期限不超过被挑战药品的原专利权期限。
③市场独占期内国家药品审评机构不停止技术审评。
part 06药品专利链接制度实际案例
2022年4月15日,北京知识产权法院公开宣判原告中外制药株式会社诉被告温州海鹤药业有限公司确认是否落入专利权保护范围纠纷一案。法院经审理认为,涉案仿制药并未落入涉案专利权的保护范围,判决驳回原告的诉讼请求。
原告中外制药株式会社研发了一款治疗骨质疏松的药物“艾地骨化醇软胶囊”,在中国取得了上市许可,并拥有相关中国发明专利,还进行了相应登记。被告温州海鹤药业有限公司向国家药监局申请上述原研药的仿制药上市许可,并声明该款仿制药未落入原告相关专利权的保护范围。原告据此向北京知识产权法院提起诉讼,请求确认该仿制药落入其专利权保护范围。
一审法院认为,涉案仿制药使用的技术方案与涉案专利权利的技术方案既不相同,亦不等同,未落入涉案专利权利要求的保护范围。中外制药株式会社不服,提起上诉。最高人民法院二审认为,海鹤公司未针对保护范围最大的权利要求作出声明,未将声明及声明依据及时通知上市许可持有人中外制药株式会社,其行为有所不当,应予批评;关于仿制药技术方案是否落入专利权利要求保护范围的判断,原则上应当以仿制药申请人的申报资料为依据比对评判;经比对,涉案仿制药采用的技术方案与涉案专利的技术方案不构成等同的技术特征,涉案仿制药的技术方案不落入涉案专利权的保护范围。原告中外制药株式会社的上诉请求不能成立,应予驳回。原审判决认定事实清楚,适用法律正确,应予维持。
part 07药品专利链接制度相关问题
药品专利链接制度虽已落地,但其问题和考验也将接踵而来:
(1)虚假声明
声明的专利信息与平台登记信息不符、声明类别错误的现象时有发生,譬如在专利平台上登记有相关专利信息,但仿制药申请人却提交了一类声明。
虽然《实施办法》规定,药品上市许可人应对其登记信息的真实性、完整性负责,仿制药申请人应依法对提交不实声明等行为承担相应责任。但在实际操作中,专利平台尚未设置专利声明的异议及修改程序,双方对声明异议出现纠纷如何解决,仍缺乏相应规则。这在一定程度上导致专利权人难以正常启动后续的纠纷处理程序。
(2)反向支付协议
反向支付协议是专利链接制度的副产品,指专利诉讼的原告反方向向被告巨额支付以换取被告延迟或放弃进入市场的和解协议。
在美国药品专利链接践行历史时期,这种事情频繁发生,也成为了美国药品专利链接制度中最大的顽疾。药品专利链接制度制定的初衷将专利权人和仿制药申请人设立在对立的基础上,而反向支付协议反而促进双方形成统一战线,无疑破坏了药品专利链接制度制定的初衷,不亚于对该制度进行了釜底抽薪。目前中国药品专利链接制度刚刚起步,未来在运行过程中也可能遇到同样的问题。
除以上问题以外,由于药品专利链接制度现还属于新生阶段,在未来实际运行过程中还会出现更多棘手的问题和困难,希望可以在汲取美国经验的基础上,结合我国自身的国情,尽早推出相应的举措办法让药品专利链接制度顺畅运行,为药品发展提供最有利的保障,最大限度地推动药品的可及性,让中国老百姓吃上好药,吃上便宜药。
注释:
[1] 深度解码专利链接制度 来源:中国知识产权资讯网
作者:品源知识产权管理咨询 刘麒














 首页
首页 电话咨询
电话咨询 联系方式
联系方式






